Лазерная очистка металла от коррозии
Кроме вышеописанных способов, существует еще один метод борьбы с коррозией металла. Он подразумевает использование лазерного оборудования. Это современная технология, которая характеризуется высокой скоростью проведения, качеством и эффективностью. Недостаток у нее только один — высокая стоимость, поэтому далеко не каждый может позволить себе ее применение. В силу высокой стоимости метода, он применяется для зачистки драгоценных металлов от коррозии и налета.
К преимуществам этого способа относятся следующие факторы:
- отсутствие выделения вредных веществ;
- автоматическое отключение лазерного луча;
- возможность работы с комбинированными материалами;
- высокая скорость и качество;
- отсутствие необходимости замены расходников.
Процедура очистки подразумевает воздействие лазерного излучения на участки, нуждающиеся в очистке от коррозии. Луч лазера воздействует исключительно на поверхности с загрязнениями. С чистых участков луч отражается, а поврежденные участки нагреваются, и тем самым осуществляется удаление с них налета.
При лазерном воздействии от нагревания происходит преобразование структуры, что вызывает в итоге отшелушивание налета. При увеличении мощности оборудования происходит процесс испарения налета. Оборудование способно нагревать заготовки до температуры в 16,5 тысяч градусов Цельсия. Процесс очистки выполняется в автоматическом режиме. Первоначально происходит сканирование рабочей поверхности, а затем фокусированный луч обрабатывает деталь.
Это интересно! Применение такого оборудования для домашнего использования является нерациональным за счет высокой стоимости.
Причины появления коррозии
Когда встает вопрос о том, ржавеет ли алюминий, необходимо задуматься о причинах, приводящих к коррозии. Различные внешние факторы могут ускорять этот процесс. Причины появления ржавчины на алюминии могут быть следующими:
Взаимодействие с какой-либо кислотой или щелочью.
Механическое давление. Например, трение или сильный удар, после чего появляется царапина на верхнем слое металла.
Существуют промышленные районы. В них продукты распада топлива влияют на оксидную пленку и разрушают ее. Металл начинает портиться. Аналогичная ситуация происходит в мегаполисах, где продукты распада топлива будут взаимодействовать с серой, а также с оксидами углерода. Подобный процесс разрушает пленку на алюминии. После такого рода внешнего воздействия алюминий подвергается коррозии.
Следует помнить, что хлор, фтор, а также бром и натрий могут растворить защитный слой металла.
Если на металл попадают строительные смеси, то он начинает быстро портиться. В данном случае на алюминий неблагоприятно воздействует цемент.
Ржавеет ли алюминий от воды? Если она попадает на лист, то металл может быть подвержен коррозионным процессам. Важно при этом уточнить, какая жидкость оказывает воздействие. Многие используют специальный сплав, который не подвержен коррозии от воды. Его называют дюралюминием. Уникальный сплав используют вместе с медью, а также с марганцем.
Как определить электрохимическую коррозию?
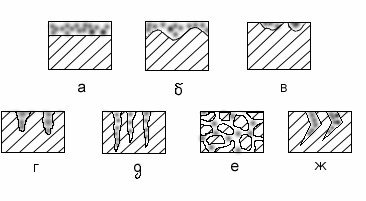
За редким исключением, коррозия формируется на поверхности металла, постепенно разрастаясь и проникая в глубокие слои. Существует несколько типов повреждений разной степени тяжести.
На рисунке показаны виды коррозионного разрушения:
- Сплошная. Покрывает всю поверхность изделия равномерным слоем. Возникает при полном контакте с электролитом, например, при нахождении изделия в растворе кислоты.
- Неравномерная. Коррозионная пленка покрывает всю поверхность изделия, но внутренние повреждения распространяются неравномерно.
- Пятна. Возникают в разных местах и не проникают на большую глубину.
- Язвы. Повреждения с глубоким проникновением. Распространение хаотичное.
- Точечная. Поражение на большую глубину. Сложный вид коррозии, так как на поверхности может выглядеть как обычное пятно, но при этом с очень глубоким проникновением.
- Межкристаллическая. Поражает кристаллическую решетку и в некоторых случаях не имеет выхода на поверхность.
- Растрескивающая. Коррозия, возникающая при одновременном контакте с электролитом, и при механическом воздействии на металл. Один из признаков старения механизмов и подвижных деталей.
Сплошная или равномерная коррозия наименее опасна в техническом плане. Она возникает по всей поверхности металла. Легко определяется на глаз и относительно просто поддается удалению. Более сложные процессы, особенно с глубоким проникновением остановить сложнее, а выявить зачастую невозможно без специальной экспертизы.

Электрохимическая коррозия – процесс неизбежный и необратимый. Однако, своевременное обнаружение позволяет принять меры по замедлению этого процесса.
Визуальное определение не дает полной картины происходящего. В частности оно не позволяет выявить кинетическую связь, то есть определить скорость протекания процесса. Для этого были разработаны различные меры контроля и преодоления коррозии:
- Металлография. Ряд методов, часть из которых позволяет проводить анализ без необходимости изъятия образцов. Существуют металлографические методы для определения межкристаллитной коррозии, благодаря которым можно выявить склонность металла к разрушению, а также скорость процесса при определенных условиях эксплуатации.
- Химические методы позволяют определить целостность структуры кристаллической решетки. Их также довольно много, а самым распространенным является кипячение нержавеющих сталей в натриевом растворе. Анализируется сам раствор на процентное соотношение в нем атомов железа к атомам хрома.
- Механические испытания. В зависимости от эксплуатационного назначения исследуемого объекта применяют методы испытания на растяжение, прочность, изгиб, вязкость, а также прочность на выдерживание давления.
- Рентген. Один из наиболее точных методов определения электрохимической коррозии, но самый трудоемкий и затратный.
Выбор метода испытания зависит от многих факторов. В частности от опасности эксплуатации поврежденного металла. В бытовых условиях коррозия определяется визуально, и в большинстве случаев этого достаточно для понимания общей картины происходящего и необходимости принятия мер.
Возвращаясь к разговору о полотенцесушителях, отметим, что наиболее стойким материалом к возникновению электрохимической коррозии считается нержавеющая сталь марки AISI 304 (наиболее качественная). Но и она может со временем дать слабину и тогда вы заметите сначала небольшие темные пятна на поверхности, увеличивающиеся в размерах и в глубине со временем.
Характерным признаком коррозии является точка-отверстие на очищенной (механическим путем) поверхности, которая свидетельствует о том, что процесс поражения водой с электричеством проходит и внутри. Конечно, существуют и дополнительные способствующие составы, присутствующие в воде — это кислород, хлор, кальций, магний, а также высокая температура! Наиболее подверженными коррозии элементами полотенцесушителя являются сварные швы, на которых в последствие появляются свищи и подтеки.

Может ли нержавейка ржаветь?
Существует три группы нержавеющих сталей, каждая из которых имеет свои особенности и специфику применения:
- Коррозионностойкая сталь. Имеет высокую стойкость к коррозии в неосложненных условиях – в быту, на производстве.
- Жаростойкая сталь. Обладает термостойкостью, не ржавеет при повышенных температурах, может применяться на химических заводах.
- Жаропрочная сталь. Остается механически прочной при высоких температурах.

Таким образом, не все виды нержавейки предназначены для эксплуатации в той или иной агрессивной среде. К примеру, использование обычной нержавеющей стали на пищевом производстве, частое мытье с хлорсодержащими средствами вызовет быструю порчу материала. Аналогично применение металла в морской воде приведет к повышению скорости коррозии в разы.
Также ржавчина часто появляется на нержавейке после сварки (термической обработки), которая была произведена без соблюдения определенных правил. После механического повреждения металла последствия будут аналогичными: в месте дефекта возникнет точечная коррозия. Гладкий, полированный материал обычно ржавеет менее интенсивно, чем шероховатый: на последнем элементы коррозии могут появиться гораздо быстрее.
Защита от ржавчины нарушается там, куда попала раскаленная окалина, поскольку от сильного повышения температуры в нежаростойкой стали происходит выгорание легирующих веществ (в основном хрома). После прогорания дыр их края и прилегающие зоны становятся подверженными коррозии, хотя более глубокие слои металла чаще всего остаются неповрежденными. Спасти нержавейку поможет обработка травильными пастами, специальными эмульсиями.
Прочие причины коррозии нержавеющей стали:
- контакт материала с обычной углеродистой сталью (в том числе посредством инструментов, которыми раньше резали простую сталь),
- регулярная чистка металлическими щетками,
- игнорирование механической или химической обработки сварного шва.

Причиной коррозии металла может стать и его изначально низкое качество. Стойкость стали к ржавлению обусловлена присутствием хрома в достаточном количестве. Этот элемент после воздействия воды, воздуха, кислот и щелочей формирует тончайший непроницаемый слой, который не дает материалу ржаветь. Если хрома в составе мало либо он распределен неравномерно, создание и поддержание оксидного слоя становится невозможным.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3.
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
3Fe + 2О2 = Fe3O4;
Fe + H2SO4 = FeSО4 + Н2.
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Возможно ли устранить следы появления электрохимической коррозии?

К сожалению, не существует стопроцентного метода защиты от коррозии, по крайней мере, экономически обоснованного. Любое изделие рано или поздно подвергнется старению, и избавиться от него будет сложно. Если изделие начало покрываться ржавчиной, в первую очередь следует определить причину.
В быту чаще всего встречается атмосферная коррозия, а способ ее устранения – нанесение неметаллических компонентов, или проще говоря, окрашивание. Однако и тут есть свои нюансы, так как если не устранить следы коррозии, она продолжит распространяться и под покрытием, сведя все старания к нулю.
Для начала необходимо устранить источник заражения. В большинстве это поверхностные очаги, которые удаляются механическим путем, то есть зачисткой. Сложности возникают с очагами глубокого проникновения, когда нет возможности снять такой слой, чтобы устранить дефект
Также особое внимание следует уделить устранению оксидной пленки с поверхности. Она является тем самым электролитом
А простой способ – это обезжиривание. Применяются любые средства с октановым числом: бензин, растворитель и так далее. Не стоит пренебрегать этим процессом, так как если на окрашенной поверхности останется пленка, разрушение продолжится даже под слоем эмали или полимера.
А еще лучше — обратиться к инженеру-проектировщику УК. Он подскажет корень проблемы и поможет с ее решением.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.
Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.
Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.
Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
Схема гальванического элемента
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
Стальной болт — медная гайка (корродирует сталь)
А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
МАРКИРОВКА И ОБЛАСТИ ПРИМЕНЕНИЯ НЕРЖАВЕЮЩЕЙ СТАЛИ
Маркировка нержавеющей стали — число указывающее на процентное содержание углерода; буквенные обозначения, дающие представление о том, какая именно примесь содержится в данном сплаве:Х-хром, Н-никель и т.д. После них идут цифровые обозначения процентного содержания примеси.
Аустенитные стали имеют свою, несколько отличающуюся от других типов маркировку:
- А1. Сталь с высоким содержанием серы. В связи с этим ее антикоррозийные свойства ниже чем у других марок.
- А2. Одна из самых популярных марок. Легко поддается разным видам обработки, в том числе сварке. Обладает хорошей холодоустойчивостью. Основным минусом является подверженность коррозиям при воздействии агрессивных кислотных сред.
- А3. Сходна по свойствам с предыдущей маркой стали, но благодаря большему содержанию усилителей, обладает большей прочностью и устойчива к кислым средам.
- А4. Содержит значительную примесь молибдена, благодаря чему имеет хорошую устойчивость к кислотам.
- А5. Имеет сходный состав с А4, но более устойчива к высоким температурным режимам.
Нержавеющая сталь зарекомендовала себя во многих промышленных сферах:
- Автомобилестроение;
- Химическая промышленность;
- Энергетика;
- Бумажная промышленность;
- Пищевая промышленность;
- Медицина.
Подробности
Коррозионные качества
Медь представляет собой металл с высокими свойствами пластичности, которые имеют красновато-золотистый цвет, а после снятия оксидной пленки немного розоватым. По электрической проводимости он будет уступать только серебру, еще характеризуется огромной степенью тепловой проводимости. За счет низкого удельного сопротивления медь используется в электротехнике – она идет на изготовление пластинок из меди, обмотки электрической двигателей, проволоки.
Обратите внимание, что из-за прекрасных антикоррозионных свойств металл будет включаться в сплавы для усовершенствования их инженерных характеристик (латунь, бронза и прочие). В гальванической среде медь превращается в катод, и начинает вступать в электрохимические процессы, а еще вызывает ускоренный процесс ржавления остальных металлов
Медь является неактивным химическим элементов, и потому она практически не взаимодействует с водой (морской или пресной), воздухом. Если воздух сухой, на поверхность материала будет формироваться оксидная пленка с толщиной до 50 мн. Изделие из меди начинает темнеть, становится зеленоватым или коричневым, и это называется патиной. Во множестве случаев патина воспринимается, как покрытие декоративного типа. Коррозионная интенсивность мала при контактировании с разведенной соляной кислотой, но при реакции со множеством остальных кислот, с галогенами, «царской водкой» металл будет окислен с образованием медного карбоната.
Условия для разрушения меди
Воздействие воды
 Защита меди от коррозии очень важна. Скорость ржавления меди в воде будет сильно зависеть от наличия пленки оксидного типа на ее поверхности, а также от уровня насыщенности воды посредством кислорода. Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Защита меди от коррозии очень важна. Скорость ржавления меди в воде будет сильно зависеть от наличия пленки оксидного типа на ее поверхности, а также от уровня насыщенности воды посредством кислорода. Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Обратите внимание, что, если на поверхности изделия, которое покрыто посредством меди, имеет зеленая или даже коричневая оксидная корочка, разрушающие компоненты в малой степени будут проникать внутрь. Как правило, слой оксида образуется спустя 2 месяца нахождения металла в воде
Намного прочнее будет считаться зеленая корочка (то есть карбонатная), рыхлой и не такой крепкой – черная (сульфатная).
В воде из моря степень коррозии почти такой же, как и в обычной, то есть пресной. Лишь при ускорении передвижения воды ржавление станет ударным, и потому более интенсивным. Медь является материалом, который не может обрастать морскими микроскопическими организмами, потому что его ионы губительные для водорослей и моллюсков. Такое свойство металла применяется в судоходстве, а также в рыбном хозяйстве.
Влияние щелочей и кислот
В щелочах медь не будет портиться, потому что материал сам по себе является щелочным, зато кислоты для нее будут являться самыми негативными по воздействию. Самая быстрая и значимая коррозия будет происходить при контактировании с серой и ее кислотными типами соединений, а азотная кислота способна полностью разрушать структуру материала. В концентрированной кислоте медь начинает растворяться, и потому при изготовлении оборудования для промышленности нефтегазового типа требуется дополнительная защита.
Рассмотрим еще кое-что, касающееся коррозии
В почве проживает большое количество микроскопических организмов, которые способны вырабатывать сероводород, так как среда тут кислая, а скорость коррозии меди возрастет. Чем больше отклонение значения рН в стороне окисления, тем скорее будут протекать разрушительные процессы. Если почва оснащена кислородом, то металл начинает окисляться, но ржаветь будет меньше. При длительном нахождении изделий из меди в земле они начинают зеленеть, становятся рыхлыми и способны даже рассыпаться. Краткосрочное пребывание в грунте вызывает образование патины, от которой предмет можно очищать. Кстати, влажный воздух способен плохо сказываться на состоянии материала лишь при длительном контакте, а для начала тоже вызывает образование патины (оксидного слоя). Исключение будет составлять пар, который насыщенный сульфидами, хлоридами, углекислотой – в нем коррозия будет развиваться стремительнее.
Как защитить медь от коррозии
Существует множество средств, которые позволяют уменьшить вероятность появления коррозии в различных средах. Среди них такие, как:
Изменение состава материала. Использование легирования позволяет значительно увеличить уровень коррозийной стойкости. При этом примеси могут быть разные – главное учитывать область использования готовой детали и понимать потенциальные риски, чтобы их устранить.
Лужение. Процесс заключается в обработке жидким оловом. На поверхности создается эффективный защитный слой. При условии отсутствия дефектов, он ограничит контакт с атмосферой и другими факторами, приводящими к появлению коррозии.
Контроль за областью использования
При закупке медных изделий важно понимать, где вы будете их применять. Требуется оградить материал от контакта с серой и ее соединениями, не допустить, чтобы поблизости располагались цинковые или алюминиевые детали
Они могут спровоцировать появление электрохимической коррозии.
Учет стандартных требований по использованию медных изделий позволит значительно увеличить срок их службы и не допустить проблем с возникновением коррозии. Вернуться к статьям Поделиться статьей
Влияние примесей на порчу металлов
Известно, что металлы в чистом виде практически не подвергаются коррозии. Но на практике все материалы содержат какое-то количество примесей. Как же влияют они на сохранность при эксплуатации изделий? Допустим, что имеется деталь, изготовленная из двух металлов. Рассмотрим, как происходит коррозия меди с алюминием. При нахождении на воздухе ее поверхность покрывается тончайшей пленкой из воды. Надо заметить, что вода разлагается на ионы водорода и гидроксид-ионы, а углекислый газ, растворенный в воде, образует угольную кислоту. Получается, что медь и алюминий, погруженные в раствор, создают гальванический элемент. Причем алюминий – анод, медь – катод (алюминий в ряду напряжений стоит левее меди).
Ионы алюминия попадают в раствор, а к меди переходят избыточные электроны, разряжая у ее поверхности ионы водорода. Ионы алюминия и гидроксид-тоны соединяются и откладываются на поверхности алюминия в виде белого вещества, вызывая коррозию.
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3,эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.

































