Способы защиты металла
Электрохимическая коррозия – одно из основных препятствий, которые встречаются на пути человеческой деятельности. Защита от воздействия разрушительных процессов и их протекания на поверхности конструкций и сооружений – одна из перманентных и насущных задач любого промышленного производства, и любой бытовой деятельности человека.

Разработано несколько способов такой защиты, и все они активно применяются в повседневном цикле жизнедеятельности:
- Электрохимическая защита – электролитическое по принципу работы использование химических закономерностей, защищает металл с помощью анодного, катодного и протекторного принципа.
- Электроискровая обработка с использованием различных установок – бесконтактных, контактных, анодно-механических.
- Электродуговое напыление – основное преимущество в толщине наносимого слоя и относительной дешевизне производимого процесса.
- Эффективная антикоррозийная обработка – удаление загрязнений и очистка обрабатываемой поверхности, с последующим нанесением на поверхность сначала противокоррозионного, а затем и дополнительного защитного слоя.
Все эти способы наработаны в процессе деятельности человека с целью защиты инструментария, средств передвижения и транспортировки на стыке нескольких промышленных отраслей, и с использованием научных достижений.
Электрохимическая коррозия, которая является естественным процессом разрушения поверхности металла под воздействием нейтральных или агрессивных факторов окружающей среды, представляет собой сложную проблему. Убытки от нее терпят и машиностроительные, и транспортные, и промышленные предприятия, средства передвижения. И это проблема, которая требует ежедневного разрешения.
Возможно ли устранить следы появления электрохимической коррозии?
К сожалению, не существует стопроцентного метода защиты от коррозии, по крайней мере, экономически обоснованного. Любое изделие рано или поздно подвергнется старению, и избавиться от него будет сложно. Если изделие начало покрываться ржавчиной, в первую очередь следует определить причину.
В быту чаще всего встречается атмосферная коррозия, а способ ее устранения – нанесение неметаллических компонентов, или проще говоря, окрашивание. Однако и тут есть свои нюансы, так как если не устранить следы коррозии, она продолжит распространяться и под покрытием, сведя все старания к нулю.
Для начала необходимо устранить источник заражения. В большинстве это поверхностные очаги, которые удаляются механическим путем, то есть зачисткой. Сложности возникают с очагами глубокого проникновения, когда нет возможности снять такой слой, чтобы устранить дефект
Также особое внимание следует уделить устранению оксидной пленки с поверхности. Она является тем самым электролитом
А простой способ – это обезжиривание. Применяются любые средства с октановым числом: бензин, растворитель и так далее. Не стоит пренебрегать этим процессом, так как если на окрашенной поверхности останется пленка, разрушение продолжится даже под слоем эмали или полимера.
А еще лучше — обратиться к инженеру-проектировщику УК. Он подскажет корень проблемы и поможет с ее решением.
Катодная защита кузова от коррозии
Автовладельцу, который задумывается о хорошем состоянии и товарном виде своего автомобиля, очень важен вопрос защиты кузова от ржавчины.
Вы, скорее всего, замечали, что купить подержанный автомобиль с идеальным лакокрасочным покрытием очень трудно. Конечно, это зависит от эксплуатации и года выпуска.
В приведенной статье рассмотрена катодная защита кузова автомобиля от коррозии, этот способ также называется электрохимической защитой.
Но особенно актуальна проблема повреждения кузова в зимнее время года, когда дороги поливают химическими реагентами. Они предотвращают обледенение проезжей части, улучшая сцепление колес, но оказывают негативное влияние на лакокрасочное покрытие.
Где применяется катодная защита от коррозии?
При любой царапине или сколе на тех местах, где имеется необработанный металл, происходит химическое взаимодействие (окисление), и как результат − появление ржавчины. Как же это предотвратить?
В Японии, например, с ее мокрым морским климатом для предотвращения ржавчины автомобили обрабатывают высокими частотами. Еще есть способ оцинковки кузова, который не очень дешевый, но действенный.
В первую очередь катодную защиту используют от коррозии:
- массивных металлоконструкций;
- металлических опор, контактирующих с грунтовыми покрытиями;
- морских сооружений и металлоконструкций;
- судов;
- трубопроводов.
Например, если газовый трубопровод, пущенный под землей, не предохранить от «повреждения», то такая труба выйдет из строя за несколько месяцев. Поэтому метод катодной защиты хорошо зарекомендовал себя не только в автомобильной, но и в других отраслях промышленности.
Катодная защита может предотвратить как полное, так и частичное разрушение металла. Она функционирует постоянно (за ней не нужно следить), поддерживая процесс восстановления «зараженной» поверхности. Также эффективно используется при различных видах коррозии, например, точечная ржавчина в виде мелких точек по поверхности.
Механизм работы катодной защиты кузова
Схема установки катодов в автомобиле
Если говорить простым языком, то кузов автомобиля станет катодом электродной пары. За анод берутся металлические поверхности, хорошо проводящие ток, а также влажный асфальт. Слабым проводником становится воздух. За счет малой разности потенциалов ржавчина появляется на аноде, а не на кузове.
Подключение катодов к аккамулятору
Очень важный момент: при катодном методе защиты используется именно разность потенциалов! Для того чтобы случайно возникший ток не расходовал заряд аккумулятора, батарея подключается к аноду через резистор, принимающий на себя ненужный заряд.
В качестве положительного полюса питания используется много вариантов, но автомобиль лучше защищен при большей площади присоединения.
Технический прогресс в развитии методов борьбы с коррозией
Так как коррозионные потери металла составляют астрономическую сумму, технический прогресс продолжает предлагать новые методы борьбы с ней, по мере развития научных исследований и совершенствования аппаратного обеспечения. К ним относятся:
- газотермическое напыление, образующее сверхтонкие защитные покрытия;
- термодиффузионные покрытия, создающие прочную поверхностную защиту;
- кадмирование, обеспечивающее защиту стали в морской воде.
Рост промышленного производства происходит с постоянным увеличением выпуска металлических изделий. Электрохимическая коррозия, вне зависимости от исторической эпохи, представляет постоянную угрозу огромному объему конструкций и ответственных сооружений. Поэтому создание новых методов и средств борьбы — одна из задач исследований технического прогресса.
Причины и признаки электрохимической коррозии
Электрохимическая коррозия отличается от химической тем, что процесс разрушения проходит в системе электролитов, отчего внутри этой системы возникает электрический ток. Два сопряжённых процесса, анодный и катодный, приводят к удалению из кристаллической решетки металла неустойчивых атомов. Ионы при анодном переходят в раствор, а электроны от анодного процесса попадают в ловушку к веществу-окислителю и связываются деполяризатором.
Таким образом, деполяризация – это отвод с катодных участков свободных электронов, а деполяризатор – вещество, которое отвечает за этот процесс. Основные реакции происходят с участием водорода и кислорода в роли деполяризаторов.

Существует множество примеров электрохимической коррозии разного типа, которая оказывает воздействие на металлические поверхности в природе и проходит под влиянием различных условий. Водород при этом работает в кислой среде, а кислород – в нейтральной.
Практически все металлы подвергаются электрохимической коррозии, и по этому признаку их разбивают на 4 группы, определяют величину их электродного потенциала:
- активные коррозируют даже в той среде, где нет окислителей;
- среднеактивные вступают в реакцию окисления в кислотной среде;
- малоактивные не вступают в реакцию при отсутствии окислителей и в нейтральных, и в кислых средах;
- не вступают в реакцию — высокой стабильности (благородные металлы, палладий, золото, платина, иридий).

Но эта же реакция может протекать и в воде, в растворах оснований, солей и кислот. В узкоспециальном различии атмосферной коррозии различают почвенную и аэрационную, морскую и биологическую (протекающую под воздействием бактерий).
Есть даже электрическая коррозия, которая протекает под воздействием электрического тока, и является результатом работы блуждающих токов, возникающих там, где электрический ток используется человеком для осуществления определенной деятельности.
Гомогенная металлическая поверхность при этом разрушается из-за термодинамической неустойчивости к окружающей среде. А гетерогенная – из-за состава кристаллической решётки, в которой атомы одного металла держатся плотнее, чем атомы инородных вкраплений. Эти реакции отличаются скоростью протекания ионизации ионов, и восстановления окислительных компонентов окружающей среды.
Разрушение металлических поверхностей при электрохимической коррозии состоит в одновременном протекании двух процессов: анодного и катодного, и отличия процессов состоят в том, что растворение происходит на анодах, которые и контактируют с окружающей средой через множество микроэлектродов, которые входят в состав поверхности любого металла и замкнуты на себя.

5 Как выполняется катодная схема?
Температурные перепады и ультрафиолетовые лучи наносят серьезный вред всем внешним узлам и составным частям транспортных средств. Защита кузова автомобиля и некоторых других его элементов от коррозии электрохимическими методами признается весьма эффективным способом продления идеального внешнего вида машины.
Принцип действия такой защиты ничем не отличается от схемы, описанной выше. При предохранении от ржавления кузова автомобиля функцию анода может выполнить почти любая поверхность, которая способна качественно проводить электроток (влажное покрытие автодороги, металлические пластины, сооружения из стали). Катодом при этом является непосредственно корпус транспортного средства.

Элементарные способы электрохимической защиты кузова автомобиля:
- Подключаем через монтажный провод и дополнительный резистор к плюсу АКБ корпус гаража, в котором стоит машина. Данная защита от коррозии кузова автомобиля особенно продуктивна в летний период, когда в автогараже присутствует парниковый эффект. Этот эффект как раз и предохраняет наружные части авто от окисления.
- Монтируем специальный заземляющий металлизированный «хвост» из резины в задней части транспортного средства так, чтобы на него во время движения в дождливую погоду попадали капли влаги. При высокой влажности между автотрассой и кузовом автомобиля образуется разность потенциалов, которая и предохраняет наружные части ТС от окисления.
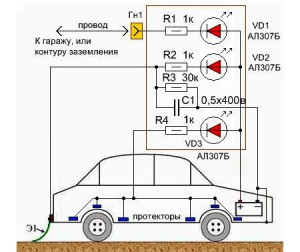
Также защита кузова автомобиля осуществляется при помощи протекторов. Их крепят на порогах машины, на днище, под крыльями. Протекторами в данном случае являются небольшие пластинки из платины, магнетита, карбоксила, графита (неразрушающиеся с течением времени аноды), а также из алюминия и «нержавейки» (их следует менять каждый несколько лет).
Необходимость антикоррозионной защиты
Защита металла от воздействий, которые разрушающе действуют на его поверхность – одна из основных задач, возникающих перед теми людьми, которые работают с механизмами, агрегатами и машинами, морскими судами и строительными процессами.

Чем активнее эксплуатируется устройство или деталь, тем больше шансов у нее подвергнуться разрушительному воздействию и атмосферных условий, жидкостей, с которыми приходится сталкиваться в процессе работы. Над защитой металла от коррозии работают многие отрасли науки и промышленного производства, но основные способы остаются при этом неизменными, и состоят в создании защитных покрытий:
- металлических;
- неметаллических;
- химических.
Неметаллические покрытия создаются с помощью органических и неорганических соединений, их принцип действия достаточно эффективен и отличается от остальных типов защиты. Для создания неметаллической защиты в промышленном и строительном производстве используются лакокрасочные составы, бетон и битум и высокомолекулярные соединения, особенно активно взятые на вооружение в последние годы, когда больших высот достигла химия полимеров.

Химия внесла свой вклад в создание защитных покрытий методами:
- оксидирования (создания защитной пленки на металле с помощью оксидных пленок);
- фосфатирования (фосфатных пленок);
- азотирования (насыщения поверхности стали азотом);
- цементации (соединения с углеродом);
- воронения (соединения с органическими веществами);
- изменения состава металла путем введения в него антикоррозийных добавок);
- модификации окружающей коррозийной среды путем введения ингибиторов, влияющих на нее.
Электрохимическая защита от коррозии – это процесс, обратный электрохимической коррозии. В зависимости от смещения потенциала металла в положительную или отрицательную стороны, различают анодную и катодную защиту. Путем подсоединения к металлическому изделию протектора или источника постоянного тока на металлической поверхности создается катодная поляризация, которая и препятствует разрушению металла через анод.
Электрохимические методы защиты состоят в двух вариантах:
- металлическое покрытие защищено другим металлом, у которого более отрицательный потенциал (то есть, защищающий металл менее устойчив, чем защищаемый), и это называется анодное покрытие;
- покрытие нанесено из менее активного металла, и тогда он является и называется катодным.

Анодная защита от коррозии – это, например, оцинкованное железо. Пока не израсходуется весь цинк с защитного слоя, железо будет в относительной безопасности.
Защита катодным способом – это никелирование или нанесение меди. В этом случае разрушение защитного слоя приводит и к разрушению того слоя, который он защищает. Присоединение протектора для предохранения металлического изделия ничем не отличается от протекания реакции в других случаях. Протектор выступает в роли анода, а то, что находится под его протекторатом, остается в сохранности, используя созданные ему условия.
Технический прогресс в развитии методов борьбы с коррозией
Так как коррозионные потери металла составляют астрономическую сумму, технический прогресс продолжает предлагать новые методы борьбы с ней, по мере развития научных исследований и совершенствования аппаратного обеспечения. К ним относятся:
- газотермическое напыление, образующее сверхтонкие защитные покрытия;
- термодиффузионные покрытия, создающие прочную поверхностную защиту;
- кадмирование, обеспечивающее защиту стали в морской воде.
Рост промышленного производства происходит с постоянным увеличением выпуска металлических изделий. Электрохимическая коррозия, вне зависимости от исторической эпохи, представляет постоянную угрозу огромному объему конструкций и ответственных сооружений. Поэтому создание новых методов и средств борьбы — одна из задач исследований технического прогресса.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл. Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Экономический ущерб от коррозии[ | ]
Коррозия ухудшает работу трубопроводов. Экономические потери от коррозии металлов огромны. В США по последним данным NACE, ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.
Обрушение Серебряного моста.
Ржавчина является одной из наиболее распространённых причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к другу конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники кронштейна моста проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не был почищен, а сточные воды проникли в опоры моста. Согласно исследованию Национального совета по безопасности на транспорте, разрушение моста было вызвано механической поломкой наружного кронштейна, удерживающего пролёт моста и его обоих штифтов. Ржавчина образовалась в подшипнике штифта. А так как её объём всегда гораздо больше, нежели исходная стальная деталь, это привело к неравномерному прилеганию друг к другу частей конструкции. В случае с мостом, ржавая масса отодвинула внутренний кронштейн от конца штифта, скрепляющего между собой наружный и внутренний кронштейны. (При этом возникло усилие, превышающее проектные пределы для зажимов, удерживающих штифты!) Из-за этого вся масса пролёта переместилась на внешний кронштейн. Эта дополнительная нагрузка на него вызвала усталостную трещину в штифте. Когда два тяжелых грузовика въехали в данную секцию моста, штифты окончательно вышли из строя, и пролёт моста упал в реку…
15 декабря 1967 года Серебряный мост, соединяющий Пойнт Плезант, штат Западная Виргиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьёзно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виргинией и Огайо. Причиной обрушения стала коррозия. Мост Кинзу в Пенсильвании был разрушен в 2003 году от торнадо прежде всего потому, что центральные основные болты проржавели, существенно снизив его устойчивость.
Протекторная защита от электрохимической коррозии
Как упоминалось выше, чем больше потенциал металла, тем быстрее происходит электрохимическая коррозия. Значит, снижая электрический потенциал, можно добиться наступления момента, когда процесс окисления станет невозможным. На этом принципе основана протекторная или, другими словами, электрохимическая защита металлических конструкций, газопроводов, корпусов морских судов. Берется такой металл, который ведет себя активнее, нежели основной защищаемый, и соединяется с последним токопроводящим проводником. Получается, что уже этот анод вступает в реакцию с коррозионной средой, а основной металл остается невредимым.
Основные случаи, когда применение протекторной защиты будет оправдано:
- Недостаточно средств на проведение более дорогостоящих защитных мероприятий.
- Если защитой нужно обеспечить конструкции из металла небольших габаритов.
- Когда трубопроводы имеют дополнительную поверхностную изоляцию.
Такую защиту от электрохимической коррозии, как протекторная, применяют, в основном, к разным маркам стали. Здесь уместным будет использование протекторов на основе кадмия, алюминия, магния, хрома, цинка, но используется не чистый элемент, а сплавы.
Цинковые протекторы
Цинковые протекторы, кроме основы из цинка, содержат:
- до 0.15% кадмия при минимально возможном процентном соотношении в 0.025%;
- до 0.5% алюминия;
- примеси железа, свинца и меди, общей суммой не превышающие 0.005%.
Наиболее эффективное применение цинка выявлено в морской воде, где с помощью таких протекторов успешно работает защита, например, газовых или нефтяных магистралей. Плюс цинка еще в том, что он допустим к использованию со взрывоопасными веществами. Когда происходит растворение анода, не наблюдается выделения загрязняющих веществ, которые могут навредить экологии.
Применение цинковых протекторов в водоемах, где вода имеет пресный состав либо в грунте под землей сопровождается быстрым образованием на поверхности протектора таких соединений, как оксиды и гидроксиды, которые приводят к торможению электрохимического процесса окисления анода, и фактически прекращается защита основного металла от электрохимической коррозии.
Установка цинкового протектора на днище корабля:

Магниевые протекторы
В чистом виде магниевые протекторы нецелесообразно применять, что объясняется быстрым ржавлением этого металла. Поэтому коррозионные защитники на базе магния, кроме него, имеют:
- максимум 5%, минимум 2% цинка;
- максимум 7%, минимум 5% алюминия;
- небольшое содержание меди, никеля и свинца, не более десятых долей процента.
Протекторы из магния хороши, когда среда, в которой они применяются, имеет pH не выше 10.5, что соответствует грунтам обычного характера, водным объектам со слабосоленой акваторией либо попросту пресной воде. Для защиты подходят любые трубопроводы и металлоконструкции, находящиеся в описанных выше условиях. Применение магния в агрессивных соленых растворах сопровождается быстрым образованием плохо растворимой пленки на его поверхности.
Алюминиевые протекторы
Целевое назначение протекторов из алюминия – работать в качестве защиты от электрохимической коррозии в средах с водой проточной с соленым составом, например, в прибрежных морских водах. В составе сплава протектора из алюминия имеются:
- примеси индия, кадмия, кремния не более 0.02%;
- цинка – до 8%;
- магния – до 5%.
Благодаря этим дополнительным металлам нет возможности появления на протекторе жесткой, задерживающей растворение пленки. Допустимо применять алюминиевый протектор и в средах, подходящих для магниевого протектора.
Основные объекты коррозии
Неоднородные металлические участки хаотично расположены на поверхности изделия и зависят от технологии и качества их изготовления, поэтому коррозионные разрушения чаще носят локальный характер. Кроме этого, локальность корродирования зависит от неоднородности:
- защитных оксидных пленок;
- электролита;
- влияния внешних факторов (нагрева, облучения);
- внутренних напряжений, вызывающих неравномерную деформацию.
Сварные и заклепочные соединения являются яркими представителями контакта инородных металлов, подвергающихся активной электрохимической коррозии. Сварка и заклепка — самые распространенные технологии в конструкции неразъемных соединений во всех ведущих отраслях промышленности и крупных трубопроводных системах:
- машиностроение;
- судостроение;
- нефтепроводы;
- газопроводы;
- водопроводы.
Наиболее значительные разрушения сварных швов и заклепочных соединений возникают в морской воде, присутствие соли в которой, значительно ускоряет процесс коррозии.
Катастрофическая ситуация сложилась в 1967 году с рудовозом «Анатина», когда морская вода от высоких штормовых волн попала в трюмы корабля. Медные конструкции во внутренней отделке трюмов и стальной корпус способствовали созданию коррозионного элемента в электролите из морской воды. Скоротечная электрохимическая коррозия вызвала размягчение корпуса судна и создание аварийной ситуации, вплоть до эвакуации команды.
Положительный эффект от электрохимической коррозии встречается очень редко. Например, при монтаже новых труб в системах горячего отопления жилых домов. Резьбовые соединения муфт начинают течь при первичном пуске до тех пор, пока продукты коррозии, состоящие из гидратированного железа, не заполнят микропоры в резьбе.
Вне зависимости от вида коррозии, химической или электрохимической, ее последствия одинаковые — разрушение изделий огромной стоимости. Причем помимо прямых потерь от пришедших в негодность материалов, существуют косвенные потери, связанные с утечками продуктов, простоями при замене негодных материалов и деталей, нарушении регламентов технологических процессов.
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3.
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
3Fe + 2О2 = Fe3O4;
Fe + H2SO4 = FeSО4 + Н2.
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Важнейшие окислители
Виды электрохимической коррозии характеризуются окислительными элементами, важнейшими из которых являются ионы водорода и кислород. При этом пленка, содержащая растворенный кислород, в коррозионном отношении значительно опаснее, чем влага, где кислорода нет, и которая способна окислять металлы исключительно ионами водорода, так как в последнем случае количество видов материалов, способных корродировать, значительно меньше.
Например, в стали и в чугуне присутствуют примеси углерода преимущественно в виде карбида железа Fe3C. В этом случае механизм электрохимической коррозии с водородной деполяризацией для указанных металлов выглядит следующим образом:
- (-) Fe — 2e + nH2O = Fe2+· nH2O (может образовываться ржавчина);
- (+) 2Н+ + 2е = Н2(в подкисленной среде);
- (+) 2Н2О + 2е = Н2 + 2ОН–(в нейтральной и щелочной среде).
Механизм коррозии железа, в котором содержатся примеси меди, в случае кислородной деполяризации катода описывается уравнениями:
- (-) Fe — 2e + nH2O = Fe2+·nH2O;
- (+) 0,5О2 + Н2О + 2е = 2ОН– (в подкисленной среде);
- (+) 0,5О2 + 2Н+ + 2е = Н2О (в нейтральной и щелочной среде).
Электрохимическая коррозия протекает с разной скоростью. Этот показатель зависит от:
- разности потенциалов между полюсами гальванического микроэлемента;
- состава и свойств электролитной среды (рН, наличие ингибиторов и стимуляторов коррозии);
- концентрации (интенсивности подачи) окислителя;
- температуры.

































