Способы защиты металла
Электрохимическая коррозия – одно из основных препятствий, которые встречаются на пути человеческой деятельности. Защита от воздействия разрушительных процессов и их протекания на поверхности конструкций и сооружений – одна из перманентных и насущных задач любого промышленного производства, и любой бытовой деятельности человека.

Разработано несколько способов такой защиты, и все они активно применяются в повседневном цикле жизнедеятельности:
- Электрохимическая защита – электролитическое по принципу работы использование химических закономерностей, защищает металл с помощью анодного, катодного и протекторного принципа.
- Электроискровая обработка с использованием различных установок – бесконтактных, контактных, анодно-механических.
- Электродуговое напыление – основное преимущество в толщине наносимого слоя и относительной дешевизне производимого процесса.
- Эффективная антикоррозийная обработка – удаление загрязнений и очистка обрабатываемой поверхности, с последующим нанесением на поверхность сначала противокоррозионного, а затем и дополнительного защитного слоя.
Все эти способы наработаны в процессе деятельности человека с целью защиты инструментария, средств передвижения и транспортировки на стыке нескольких промышленных отраслей, и с использованием научных достижений.
Электрохимическая коррозия, которая является естественным процессом разрушения поверхности металла под воздействием нейтральных или агрессивных факторов окружающей среды, представляет собой сложную проблему. Убытки от нее терпят и машиностроительные, и транспортные, и промышленные предприятия, средства передвижения. И это проблема, которая требует ежедневного разрешения.
Методы защиты
Электрохимическая защита металлов от коррозии достигается следующими способами:
- Созданием антикоррозионных сплавов (легированием).
- Увеличением чистоты индивидуального металла.
- Нанесением на поверхность различных защитных покрытий.
Эти покрытия в свою очередь бывают:
- Неметаллическими (краски, лаки, смазочные материалы, эмали).
- Металлическими (анодные и катодные покрытия).
- Образованными специальной обработкой поверхностей (пассивация железа в концентрированных серной или азотной кислотах; железа, никеля, кобальта, магния в растворах щелочей; образование оксидной пленки, например, на алюминии).
Отличия химической коррозии от электрохимической
Под процессом электрохимической коррозии понимают окислительно-восстановительную реакцию коррозионной среды за счет электронов металла, которые отнимаются у него под воздействием электрического потенциала, возникающего в электролите, коим является эта окислительная среда. Ионизация сопровождается разрушением той части, которая непосредственно контактирует со средой, а ржавчина, видимая невооруженным глазом, не что иное, как восстановленная коррозионная среда.
- Сущностью электрохимической коррозии является процесс, протекающий в электролите, и это главное.
- В электрохимической обязательно присутствует электрический ток, чего нет при химическом окислении.
- Электрохимическая коррозия характеризуется не одномоментным переходом частиц от металла к окислительному компоненту, а определяется величиной потенциала. То есть, чем потенциал выше, тем больше скорость движения частиц и быстрее восстановительный процесс коррозионной среды. При химическом же процессе разрушение вещества сопровождается одновременным восстановлением коррозионной среды.
Выделяют следующие виды электрохимической коррозии:
- Межкристаллитная. Электрохимическое явление, когда у алюминия, никеля, иных элементов наблюдается разрушение зерна по его границе, и происходит это избирательно. В результате конструкция теряет свою прочность, ухудшаются свойства пластичности. Опасность в том, что этот электрохимический процесс визуально может быть незаметен.
- Питтинговая. Проявляется как поражение точечных участков на таких элементах, как медь, ее сплавы и другие. Размер отдельных участков, где проявляется коррозия, обычно не превышает 1.5 миллиметров. Электрохимический питтинг бывает поверхностного типа, а также открытый и закрытый.
- Щелевая. Опасный вид электрохимической коррозии, сопровождающийся быстрым усиленным разрушением областей, где есть микротрещины, зазоры либо щели. Коррозия может протекать при любом состоянии окружающей среды.
Что происходит с металлом в процессе коррозии
Поверхность металлических объектов в химически или электрически активной среде постепенно разрушается, окисляясь и теряя частицы металла. Их замещение на более хрупкие окислы приводит к потере прочности, изменению эксплуатационных характеристик объекта.
Под действием электролитов (конденсат, дождевая вода и снег, морская и речная, озерная вода, растворы щелочей и кислот, жидкости с высоким содержанием солей) на поверхности металла образуются так называемые гальванические элементы. В зависимости от химического потенциала соприкасающихся материалов металл быстрее или медленнее растворяется. Особенно сильно воздействие коррозии на границе двух металлов – например, в местах установки заклепок на металлический лист или по сварочным швам.

При химической коррозии электрических процессов нет, идет прямое окисление металла атмосферным (или находящимся в газовой, жидкой среде) кислородом. Так, например, образуется окалина при нагреве железистых сплавов до высоких температур (например, во время ковки).

На фото слева – часть кованого ножа, еще не очищенного от окалины, справа – уже отшлифованная.
Отдельно стоит рассмотреть процесс так называемой питтинговой коррозии (язвенной). Этот термин связан с англоязычным понятием pitting, от pit — покрывать(ся) ямками, язвами. В процессе такого разрушения на поверхности металла образуются вначале мелкие, точечные ямки и полости, которые затем разрастаются в глубь массива.

Первичные нарушения целостности наблюдаются в тех местах, где на поверхности металлической детали есть микроповреждения – выход на поверхность зерен, микротрещин, пор, различных включений. Очень часто причиной начала язвенной коррозии являются остатки прокатной окалины, не полностью удаленной при механической обработке и/или нанесении защитного слоя.

Электрохимическая защита
Достаточно результативный способ защиты металлоконструкций от электрохимической коррозии. Иногда воссоздать лакокрасочную оболочку или защитное оберточное покрытие просто невозможно. Вот в таких случаях и уместно применение электрохимической защиты.
- Используется метод в ситуациях, когда потенциал свободной коррозии пребывает в области усиленного распада основного металла или перепассивации. То есть, когда металлоконструкция интенсивно разрушается.
- При электрохимической защите к изделию из металла подключают постоянный электрический ток. Благодаря ему на поверхности металлической конструкции образуется катодная поляризация электродов микрогальванических пар и анодные области становятся катодными. А вследствие негативного влияния коррозии разрушается не металл, а анод.
- Электрохимическая защита может быть анодной или катодной: это будет зависеть от того, в какую сторону сдвинется потенциал металла (в положительную или в отрицательную).
Электродренажная защита
Это способ защиты трубопроводов от разрушения с помощью блуждающих токов. Метод предусматривает их дренаж (отвод) с защищаемой конструкции на источник блуждающих токов или специальное заземление.
- Дренаж бывает прямым, поляризованным и усиленным. Прямой электрический дренаж — это дренажное устройство, имеющее двустороннюю проводимость. При величине тока, превышающей допустимую величину, выйдет из строя плавкий предохранитель. Электрический ток пойдет по обмотке реле, оно включится, после чего произойдет включение звука или света.
- Прямой электрический дренаж используют для тех трубопроводов, чей потенциал всегда выше потенциала рельсовой сети, служащей для отвода блуждающих токов. Иначе отвод станет каналом для натекания блуждающих токов на трубопровод.
- Поляризованный электрический дренаж является дренажным устройством, имеющим одностороннюю проходимость. Отличие поляризованного дренажа от прямого заключается в присутствии у первого элемента односторонней проводимости ВЭ. В случае поляризованного дренажа ток течет только в одном направлении — от трубопровода к рельсу. Это не позволяет блуждающим токам натекать на трубопровод по дренажному проводу.
- Усиленный дренаж используется тогда, когда требуется не только отвести блуждающие токи с трубопровода, но и создать на нем определенную величину защитного потенциала. Усиленный дренаж – это обычная катодная станция. Ее отрицательный полюс подсоединяют к защищаемой конструкции, а положительный — к рельсам электрифицированного транспорта, а не к анодному заземлению.
- Как только трубопровод введут в эксплуатацию, регулируют работу системы его защиты от коррозии. Если возникает необходимость, осуществляют подключение станций катодной и дренажной защиты и протекторных установок.
Использование какой-либо из технологий защиты промысловых, стальных и прочих видов трубопроводов от коррозии – обязательная составляющая их эксплуатации. Все методы антикоррозийной защиты требуется реализовывать в строгом соответствии с ГОСТом.
Электрохимическая коррозия и ее причины
Электрохимическая коррозия является самым распространенным видом коррозии. Она возникает в случаях контакта металла с электролитически проводящей окружающей средой.
При данном процессе, восстановление окислительного компонента коррозионной среды проходит в отличительное от ионизации атомов металла время и электродный потенциал влияет на их скорость. Первопричина, по которой возникает электрохимическая коррозия металлов — термодинамическая неустойчивость металла в окружающей его среде. Ржавление обивки днища корабля, трубопровода, металлических конструкций в атмосфере — все это частные случаи электрохимической коррозии. Для борьбы с электрохимической коррозией нужно знать механизм ее работы и причины возникновения. Протекание механизма коррозии может осуществляться по двум вариантам. Гомогенный: • Поверхностный слой металла рассматривается как однородный и гомогенный; • Причина растворения металла заключается в термодинамической возможности протекания анодного или катодного актов; • Анодные и катодные участки мигрируют по металлической поверхности; • На скорость коррозии влияет кинетический фактор; • Однородная поверхность может быть рассмотрена, как предельный случай, реализация которого возможна и в жидких металлах. Гетерогенный: • Из-за различных положений атомов в кристаллической решетке твердые металлы имеют негомогенную поверхность; • Гетерогенность актуальна при наличии инородных включений в сплаве. Электрохимическая коррозия металлов имеет ряд особенностей: делится на анодный и катодные процессы, кинетически зависящие друг от друга и протекающие одновременно; на некоторых металлических поверхностях коррозия принимает локальных характер; основной металл растворяется на анодах. Поверхность металла представляет собой множество короткозамкнутых электродов. При контакте с коррозионной средой образуется гальванический элемент, способствующий электрохимическому разрушение. Существует три основные причины возникновения местного гальванического элемента: • Неоднородность металлического сплава: наличие микро- и макровключений, микро- и макропор, зерен кристаллов; • Неоднородность среды: область с ограниченным доступом окислителя выступает анодом по отношению к участку со свободным доступом; • Неоднородность физических условий: облучение, воздействие температуры и внешних токов.
На нашем заводе вы всегда сможете заказать теплообменники, а так же редуктор вертикальный цилиндрический одноступенчатый.
Производимые предприятием теплообменники и емкости:
- маслоохладители турбин и трансформаторов, воздушные и водяные
- газоохладители го турбогенераторов
- подогреватели сетевые псв
- трубы оребренные
- воздухоохладители электромашин
Применение ингибиторов коррозии
По свойствам эти сложные химические составы делятся на две группы – средства, уменьшающие коррозионную активность внешней среды (пассиваторы) и комплексы, образующие на поверхности защищаемого изделия предохраняющий от коррозии слой адсорбирующего типа (адсорбаторы).
Кстати, для тех, кто не знает точно, чем различаются аБсорбция и аДсорбция. В первом случае это поглощение из газовой среды веществ жидкостью, во втором – поглощение веществ из той же среды поверхностным слоем твердого тела.
Очень часто ингибиторы применяют в магистралях и локальных системах отопления. В этом случае существенно уменьшается внутренняя коррозия трубопроводов и радиаторов отопления под действием теплоносителя.
Важно: в автономных замкнутых системах, работающих на дистиллированной воде, применение ингибиторов коррозии обычно не обосновано.
Также ингибиторы, в сочетании с другими компонентами, используются для профилактики и очистки водопроводов, водонагревающих устройств.
Также широко распространено применение ингибиторов в строительстве, в том числе в создании арматуры железобетонных конструкций. Обработка специальным составом препятствует коррозии арматуры в монолите и продлевает срок службы железобетона. Также сохраняется нагрузочная способность конструкции, поскольку целостность арматуры позволяет сохранять нормальный уровень сопротивления нагрузкам.
Используются ингибиторы как в виде жидкостей, так и в виде газов, вводимых в окружающую изделие среду.
Способы защиты труб от коррозии
Можно выделить три главных способа защиты труб от коррозии:
- Активный способ – используется электрический ток;
- Пассивный способ – применяется для защиты трубопроводов под землей и может осуществляться тремя различными способами: особый способ укладки с образование воздушного кармана между грунтом и стенками трубопровода, обработка поверхности специальными составами и антикоррозийными покрытиями;
- Уменьшение агрессивности среды — введением в эту среду соединений, уменьшающих скорость коррозийного износа.
| Наименование | Срока эксплуатации | Срок эксплуатации |
| активный | применяется электрический ток | ≤5 лет |
| пассивный | нанесение покрытия из специальных составов | ≤3 лет |
| уменьшение агрессивности среды | удаление веществ, образующих коррозия с помощью ингибиторов | 1-2 года |
Основные объекты коррозии
Неоднородные металлические участки хаотично расположены на поверхности изделия и зависят от технологии и качества их изготовления, поэтому коррозионные разрушения чаще носят локальный характер. Кроме этого, локальность корродирования зависит от неоднородности:
- защитных оксидных пленок;
- электролита;
- влияния внешних факторов (нагрева, облучения);
- внутренних напряжений, вызывающих неравномерную деформацию.
Сварные и заклепочные соединения являются яркими представителями контакта инородных металлов, подвергающихся активной электрохимической коррозии. Сварка и заклепка — самые распространенные технологии в конструкции неразъемных соединений во всех ведущих отраслях промышленности и крупных трубопроводных системах:
- машиностроение;
- судостроение;
- нефтепроводы;
- газопроводы;
- водопроводы.
Наиболее значительные разрушения сварных швов и заклепочных соединений возникают в морской воде, присутствие соли в которой, значительно ускоряет процесс коррозии.
Катастрофическая ситуация сложилась в 1967 году с рудовозом «Анатина», когда морская вода от высоких штормовых волн попала в трюмы корабля. Медные конструкции во внутренней отделке трюмов и стальной корпус способствовали созданию коррозионного элемента в электролите из морской воды. Скоротечная электрохимическая коррозия вызвала размягчение корпуса судна и создание аварийной ситуации, вплоть до эвакуации команды.
Положительный эффект от электрохимической коррозии встречается очень редко. Например, при монтаже новых труб в системах горячего отопления жилых домов. Резьбовые соединения муфт начинают течь при первичном пуске до тех пор, пока продукты коррозии, состоящие из гидратированного железа, не заполнят микропоры в резьбе.
Вне зависимости от вида коррозии, химической или электрохимической, ее последствия одинаковые — разрушение изделий огромной стоимости. Причем помимо прямых потерь от пришедших в негодность материалов, существуют косвенные потери, связанные с утечками продуктов, простоями при замене негодных материалов и деталей, нарушении регламентов технологических процессов.
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Коррозия некоторых металлов
Коррозия меди
Коррозия меди – это ее разрушение под влиянием окружающей среды. Медь в разных концентрациях в других металлах имеет широкое применение в массе отраслей промышленности всего мира. Медь используется в строительстве в связи с максимальной коррозионной устойчивостью этого металла и ее высокой степенью теплопроводности.
Коррозия железа
Окислительная реакция во время коррозии железа проходит путем прохода электронов на окислитель. Продукт коррозии этого вида металла — ржавчина. На практике вы можете видеть ржавчину с достаточно разнообразной гаммой оттенков — от темно-красного и до светло-оранжевого, либо практически черного оттенка.
Влияние коррозии на алюминий
Коррозия алюминия наблюдается во многих средах и может не проходить лишь в тех случаях, в которых на верхней части металла образовалось защитное покрытие.
Важно помнить, что щелочи способны быстро растворить защитную пленку алюминия, который начинает свою реакцию с водой. В итоге металл обычно растворяется в среде с выделением большого количество водорода
Таким образом проходит «коррозия алюминия и его сплавов» в природе.
Что такое коррозия
Процесс разрушения верхнего слоя металлического материала под влиянием внешних воздействий называется коррозией в широком смысле.

Термин коррозия в данном случае – только характеристика того, что металлическая поверхность вступает в химическую реакцию и теряет под её влиянием свои изначальные свойства.
4 основных признака, по которым можно определить, что этот процесс существует:
- процесс, развивающийся на поверхности, и со временем проникающий внутрь металлического изделия;
- реакция возникает самопроизвольно от того, что нарушается устойчивость термодинамического баланса между окружающей средой и системой атомов в сплаве или монолите;
- химия воспринимает этот процесс не просто, как реакцию разрушения, но как реакцию восстановления и окисления: при вступлении в реакцию одни атомы замещают другие;
- свойства и особенности метала при такой реакции претерпевают значительные изменения, или утрачиваются там, где она происходит.
Методы защиты металлов от коррозии

Коррозия каждый приводит к тому, что появляется большое количество убытков. Они исчисляются миллионами. Ущерб наносится не потому, что коррозия уничтожает металлы, а потому что в результате этого процесса портятся вещи из металлических материалов. В мире применяется большое количество оборудования, которое в большинстве своем сделано из металлической основы. Его стоимость является достаточно высокой. После выхода из строя оборудования не каждая организации имеет возможность приобрести еще одно такого же уровня. Именно поэтому так необходима защита от коррозии.
В современном мире очень важно правильно подобрать средства для борьбы с появлением ржавчины на металлических изделиях. Необходимо перед нанесением краски тщательно подготовить металлическую поверхность
От этого зависит восемьдесят процентов противостояния образованию коррозии. Лакокрасочные материалы, которые наносятся в последующем, обеспечивают лишь двадцати процентную защиту. Сегодня для обработки металлических поверхностей можно использовать специальные преобразователи ржавчины, которые выполняют роль и защиты и грунтовки.
Защита автомобильной техники от коррозии
Обслуживание личного авто или другой техники – это именно та область, где люди чаще всего сталкиваются с коррозионными явлениями и необходимостью защиты от них.
Поэтому отдельно рассмотрим средства для защиты автомобилей, других транспортных средств и механизмов от коррозии и связанных с ней поломок.
Гидроизолирующие мастики. Чаще всего встречаются битумно-каучуковые, резино-битумные, сланцевые. По сути дела, это жидкая гидроизоляция, которая в горячем или холодном виде наносится на металлические (и не только) элементы механизмов. Получается достаточно стойкая защита от действия атмосферной влаги, как в прямом виде (дождь, снег), так и конденсата, а также от воды в процессе мытья техники. Использование возможно только на внутренних элементах механизмов (под капотом автомобиля или на его днище, например). Впрочем, при низких требованиях к эстетике возможна и наружная обработка – все зависит от назначения элемента и особенностей его работы.
Обмазочные материалы на основе парафина, воска или нефтяного масла. Создают на поверхности металлических деталей тонкую эластичную пленку, предохраняющую от коррозии. Требуют периодического возобновления покрытия, особенно на поверхностях, активно подвергающихся внешнему воздействию. Среди перечня этих средств стоит выделить так называемое «Пушечное сало».
Жидкие маловязкие материалы для скрытых полостей. Используются для обработки труднодоступных элементов техники, куда можно проникнуть только через технологические отверстия малого диаметра – соответственно, обмазочная изоляция невозможна. Маловязкие жидкости, имеющие очень высокую текучесть, обволакивают детали и вытесняют с их поверхности влагу, образуют полувысыхающую стойкую пленку.
Аэрозольные составы. Принцип их действия тот же, что и у обмазочной гидроизоляции, различие лишь в способе нанесения. Почти всегда составы содержат ингибиторы коррозии.
Таким образом, обработка днища автомобиля от коррозии – места, больше всего подверженного ржавлению – и других элементов машины возможна любым из перечисленных типов средств, в зависимости от условий эксплуатации и назначения/расположения защищаемой детали.
Обработка агрессивной среды
Этот метод является эффективным, когда электрохимическая коррозия железа протекает в небольшом объеме токопроводящей жидкости. Справиться с разрушительными процессами в этом случае можно двумя способами:
- Удалением из жидкости кислорода (деаэрация) в результате продувки инертным газом.
- Введением в среду ингибиторов – так называемых замедлителей коррозии. Например, в случае если поверхность разрушается в результате окисления кислородом, добавляют органические вещества, молекулы которых содержат определенные аминокислоты (имино-, тио- и другие группы). Они хорошо адсорбируются на поверхности металла и существенно снижают скорость электрохимических реакций, приводящих к разрушениям поверхностного контактного слоя.
Способы защиты металлов от химической коррозии
Полностью предотвратить разрушение металлов в результате химического взаимодействия с агрессивными веществами, присутствующими в окружающей среде, невозможно. Однако этот процесс можно значительно замедлить. Для решения данной задачи используются следующие способы:
- уменьшение агрессии окружающей среды;
- повышение коррозиеустойчивости металла;
- исключение контакта между металлом и агрессивными веществами из окружающей среды.
Чтобы повысить коррозиеустойчивость стали, в нее включают легирующие добавки. Для покрытия металлов в целях противокоррозийной защиты используются другие металлы или неметаллические составы. Например, железо защищается от коррозии путем нанесения на его поверхность алюминия, цинка или никеля. Покрытия из
неметаллических составов выполняются при помощи разнообразных красок, лаков и полимеров, которые формируют на поверхности металлов защитную пленку, предотвращающую их контакт с окружающей средой. Преимущество использования красок и лаков заключается в наличии возможности наносить их на месте установки металлических конструкций. Кроме того, этот способ не требует больших затрат времени и денег и может применяться неоднократно по мере необходимости.

Современные методы борьбы
Многочисленные исследования и развитие технического прогресса привели к созданию целой системы методов и средств в борьбе с коррозией. Можно отметить три основных направления в защите от коррозии:
- Конструктивные решения.
- Активные методы.
- Пассивные методы.
Конструктивные решения состоят в выборе материалов, которые минимально поддаются коррозии по своим физическим свойствам:
- нержавеющие стали;
- легированные стали;
- цветные металлы.
 Активные методы борьбы подсказала сама электрохимическая коррозия. Постоянное напряжение прикладывают к защищаемой металлической конструкции так, чтобы повысить его электродный потенциал и замедлить процесс электрохимического растворения. Второй вариант активной защиты — жертвенный анод, который имеет низкий электродный потенциал, вследствие чего разрушается вместо защищаемого объекта.
Активные методы борьбы подсказала сама электрохимическая коррозия. Постоянное напряжение прикладывают к защищаемой металлической конструкции так, чтобы повысить его электродный потенциал и замедлить процесс электрохимического растворения. Второй вариант активной защиты — жертвенный анод, который имеет низкий электродный потенциал, вследствие чего разрушается вместо защищаемого объекта.
Пассивные методы состоят в нанесении защитных покрытий. Технический прогресс в этой области начал развиваться с нанесения простейших лакокрасочных покрытий, предотвращающих попадания кислорода, влаги и конденсата на поверхность металлов. Затем появились гальванические покрытия на основе:
- цинка — цинкование;
- хрома — хромирование;
- никеля — никелирование.
Оцинкованное железо, никелированные и хромированные столовые приборы, консервные банки с продуктами служат многие годы, не поддаваясь электрохимической коррозии, сохраняя красивый внешний вид, предохраняя порчу продуктов.
Виды коррозийных процессов
Коррозия металлов имеет большое количество разновидностей. Но в основном все виды подразделяются на два основных типа:
- Коррозия общего характера. Она называется равномерной, а встречается чаще всего. Причиной возникновения такой коррозии считаются химические и электрохимические реакции. Такая разновидность коррозии приводит к отрицательному воздействию на всю поверхность материала и металлической конструкции. При этом процесс может быть равномерным или неравномерным. При неравномерном распределении ржавчины, она на одном участке разъедает материала быстрее и сильнее, чем на соседнем.
- Местный вид коррозии. Возникает на одном участке, где и развивается.
- Местная пятнами. Возникает на отдельных участках материала.
- Язвенная, ее еще называют питтинг.
- Межкристаллитная — такая коррозия возникает на пограничных областях металлического кристалла. Чаще вспыхивает в тех материалах, которые содержат в составе никель и алюминий. Металл в кратчайшие сроки остается без первоначальных показателей прочности и эластичности.
- Растрескивающая.
- Подповерхностная.
- Коррозия под током — возникает под воздействием блуждающего или постоянного тока.
- Коррозийная кавитация — вариант разрушений, когда помимо ржавчины на металл воздействует и ударная сила.
- Фреттинг-коррозия — одновременное воздействие ржавчины и вибрации, которые совместно приводят к разрушению металлических конструкций. варианты.

Есть еще различия и по механизму воздействия.
См.также: Самые дорогие металлы в мире
Химический вариант разрушения
Это разновидность процесса, при котором рушатся связи металлические, а между атомами веществ материала и окислителей возникает химическая взаимодействие. В такой ситуации не образуется электрический ток между различными областями материала. В свою очередь такой вид разрушения подразделяется еще на два типа:
- Газовый вариант. Получается при воздействии агрессивных азов, а также паров в сочетании с высокими показателями температуры. Если материал относится к активным, то воздействие таких сред может привести к окончательному разрушению материала по всей поверхности. К таким средам относятся: сероводород, диоксид серы, пары воды, кислород. Такой вид разрушительного процесса чаще всего заметен в промышленности и на химическом производстве.
- Жидкостный вариант ржавчины. Случается в неэлектролитических веществах. Если имеется даже небольшое содержание жидкости, то процесс становится электрохимическим.
Важно, что при химической разновидности коррозии металл разрушается со скоростью протекания химической реакции. См.также: Обработка металла давлением
См.также: Обработка металла давлением
Электрохимическая ржавчина
Этот вариант разрушительных процессов возникает в среде электролитов. Процесс сочетается с возникновением тока. В итоге из решетки вещества убирается атом и одновременно протекают два процесса:
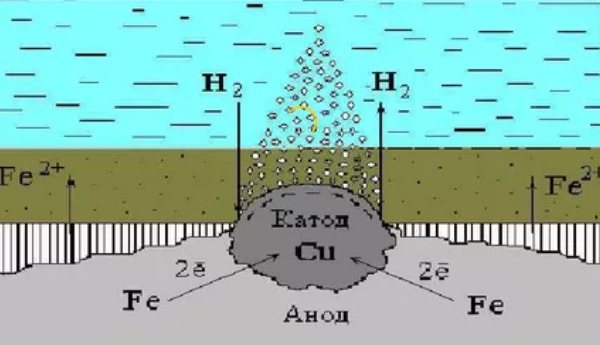
- Анодный — вещество материала в качестве ионов входит в раствор.
- Катодный — те вещества, которые получаются в предыдущем процессе, связываются при помощи деполяризатора.
Собственно отвод электродов так и называется — деполяризация, а непосредственно вещества, которые способствуют данному процессу именуются деполяризаторами.
Наиболее часто возможно встретить вариант разрушения с водородной и кислородной деполяризацией.
Виды коррозии
Коррозионный процесс портит жизнь людям многие века, поэтому он изучен достаточно широко. Существуют различные классификации коррозии в зависимости от типа окружающей среды, от условия использования коррозирующих материалов (находятся ли они под напряжением, если контактируют с другой средой, то постоянно или переменно и пр.) и от множества других факторов.
Электрохимическая коррозия
Коррозировать могут два различных металла, соединенных между собой, если на их стык попадет, например, конденсат из воздуха. У разных металлов различные окислительно-восстановительные потенциалы и на стыке металлов образуется фактически гальванический элемент. При этом металл с более низким потенциалом начинает растворяться, в данном случае, коррозировать. Это проявляется на сварочных швах, вокруг заклепок и болтов.
Для защиты от такого вида коррозии применяют, например, оцинковку. В паре металл-цинк коррозировать должен цинк, но при коррозии у цинка образуется оксидная пленка, которая сильно замедляет процесс коррозии.
Химическая коррозия
Если поверхность металла соприкасается с коррозионно-активной средой, и при этом нет электрохимических процессов, то имеет место т.н. химическая коррозия. Например, образование окалины при взаимодействии металлов с кислородом при высоких температурах.































